Bernhard
Peter
Das
Enterotoxin von Escherichia coli
Reisedurchfälle
- hier ist einer der Bösewichter!
Durchfallerkrankungen stellen
die häufigsten Gesundheitsprobleme während und nach
Auslandsreisen dar, insbesondere in tropische und subtropische
Länder mit geringer Hygiene. Meist verlaufen die Durchfälle
selbstlimitiert. Es gibt jedoch auch schwerwiegende oder
chronische Infektionen des Darmtrakts, die von einem
vielfältigen Erregerspektrum verursacht werden können, am
häufigsten (ca. 80 %) sind jedoch Bakterien daran schuld,
insbesondere Enterotoxin-bildende Escherichia coli (ETEC),
Campylobacter, Salmonellen und Shigellen sowie auch
nichtbakterielle Erreger wie Rotaviren und Lamblien. Häufigste
Ursache (ca. 50%) sind Infektionen mit Enterotoxin-bildenden
Escherichia coli (ETEC).
Was ist
ein Enterotoxin?
Ein Enterotoxin ist ein Gift,
welches den Darm angreift und oft Verursacher von Gastroenteritis
ist. Viele Bakterien bilden Enterotoxine, wie z. B. Vertreter der
Gattungen Clostridium, Bacillus, Staphylococcus, Shigellen,
pathogene Escherichia coli, Yersinia enterocolitica, Vibrio (Cholera), Aeromonas, Campylobacter u.v.a.m.
Escherichia
coli - auf einmal böse?
Escherichia coli, ganz normale
Colibakterien, gehören zu einer gesunden Darmflora. Im Dickdarm
eines Gesunden kommen Colibakterien millionenfach vor, und alles
ist in Ordnung.
Einige Stämme können jedoch mehr als die harmosen Darmbewohner, sie haben die Fähigkeit erworben, Giftstoffe, nämlich die Enterotoxine zu bilden. Man nennt diese Stämme auch Pathovare. Vertreter des Stammes ETEC (Enterotoxin bildende Escherichia coli) sind häufige Erreger der Reisediarrhoe und unliebsame Begegnungen bei Fernreisen. Daneben gibt es auch noch schlimmere Darminfektionen, die durch noch bösere EHEC-Stämme verursacht werden (Entero-hämorrhagische Escherichia coli). EHEC-Infektionen zählen zu den häufigsten Lebensmittelvergiftungen. Dann gibt es noch die EIEC, die enteroinvasiven Escherichia coli, die die Schleimhaut des Colons penetrieren können und geschwürige Entzündungen verursachen.
Enterotoxische Escherichia coli (ETEC) haben zwei Toxine: Ein hitzelabiles LT (hier beschrieben) und ein hitzestabiles ST. Es gibt Stämme, die das eine oder das andere oder beide Gifte produzieren.
Konzept
des Enterotoxins LT von Escherichia coli
Das beim Choleratoxin allgemein über bakterielle Toxine Geschriebene
gilt analog auch für das Enterotoxin von E. coli. Auch dieses
Toxin benutzt die drei dort genannten Strategien, um besonders
wirkungsvoll zu sein:
Es handelt sich um ein Eiweiß. Proteine wirken katalytisch, können ihre schädliche Aktion immer wieder und wieder ausführen. Ein einziges Molekül kann also die Chemie einer ganzen Zelle in seinem Sinne verändern. Das Enterotoxin, einmal in eine Zelle geschleust, ruht nicht eher, als bis die ganze Zellchemie verändert ist und die Zelle zusammenbricht.
Solche Bakteriengifte wählen sich ihr Ziel. Es besitzt einen Zielerkennungsmechanismus. LT stellt ein dem Choleratoxin sehr ähnliches Gift dar. Das ganze Enterotoxin besteht aus insgesamt sieben Ketten. Es besteht aus 5 B-Untereinheiten, die für die Bindung an Rezeptoren der Darmepithelzelle verantwortlich sind. 5 von 7 Aminosäureketten dienen also nur der Zielerkennung, die anderen beiden Ketten (A1 und A2) sind Schadensverursacher.
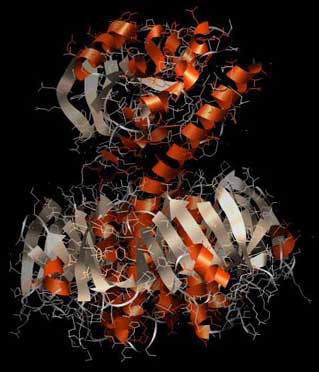
Die Abbildung zeigt den Aufbau des Enterotoxins von der Seite: Es ähnelt in der Form einem Stempel. Unten ein breiter Unterbau wie ein oben abgerundeter fünfeckiger Sockel, darüber eine schmale Wespentaille, dann oben der Stempelgriff mit seiner charakteristischen langen Alpha-Helix.

Abb.: 3D-Raumstruktur des Enterotoxins LT von Escherichia coli, PDB-ID 1LTB, visualisiert mit Chimera. Seitenansicht, unten Erkennungsregion, oben eigentliches Gift. Orange die Alpha-Helices, silbern die Beta-Faltblattstruktur
Die „Stempelfläche“, der untere Teil, ist die Region, mit der das Gift an der Zielzelle andockt. Hier ist die Erkennungsregion für die Zielzellen. Der „Stempelgriff“ ist dagegen der Schadensbringer selbst, der hier im Huckepack obendrauf sitzt. Er ist der eigentliche Bösewicht, der aber nur dann in Aktion tritt, wenn die „Stempelfläche“ ihr Ziel erkennt, an der Zelle andockt und das Gift einschleust. Das erklärt, warum die Gifte so effektiv sind.
Betrachten wir die „Stempelplatte“ genauer: Der Blick von unten offenbart, daß hier genau wie beim Choleratoxin fünf mal die gleiche Proteinkette im Kreis angeordnet ist, ein höchst symmetrisches Gebilde.
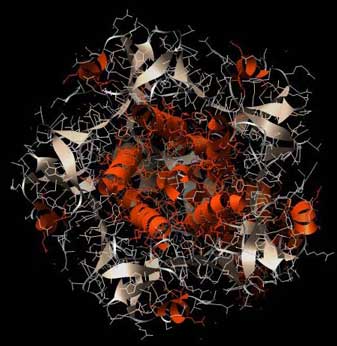
Abb.: 3D-Raumstruktur des Enterotoxins LT von Escherichia coli, PDB-ID 1LTB, visualisiert mit Chimera. Blick von unten auf die Erkennungsregion mit C5-Symmetrie, bestehend aus 5 gleichen Aminosäure-Ketten. In der Abbildung ist die C5-Symmetrie der Sekundärstruktur hervorgehoben.
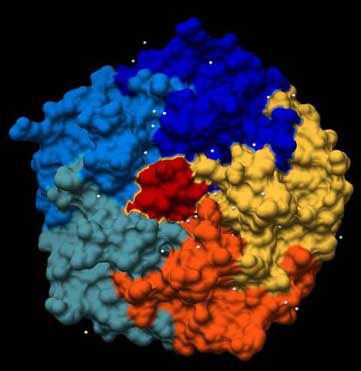
Abb.: 3D-Raumstruktur des Enterotoxins LT von Escherichia coli, PDB-ID 1LTB, visualisiert mit Chimera. Blick von unten auf die Erkennungsregion mit C5-Symmetrie, bestehend aus 5 gleichen Aminosäure-Ketten. In der Oberflächendarstellung ist die Zusammensetzung des Haptomers aus fünf gleichen, aber separaten Aminosäureketten dargestellt. Weiße Punkte sind Wassermoleküle.
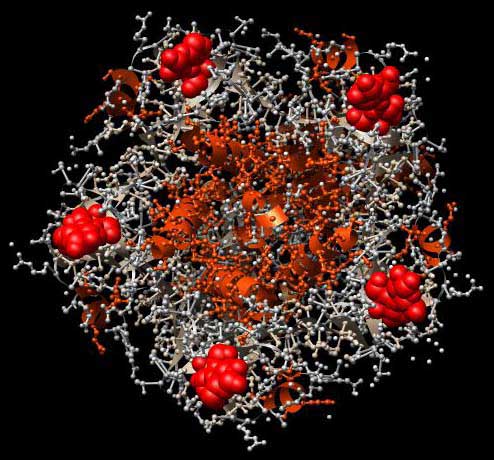
Abb.: 3D-Raumstruktur des Enterotoxins LT von Escherichia coli, PDB-ID 1LTT, visualisiert mit Chimera als Kugel-Stab-Darstellung. Blick von unten auf die Erkennungsregion mit C5-Symmetrie, bestehend aus 5 gleichen Aminosäure-Ketten. Rote Kalotten stellen beispielhaft Zuckerliganden dar.
Diese Proteinketten binden an Kohlenhydratstrukturen auf der Zelloberfläche. Wenn die richtigen Zellen mit den richtigen Oberflächenstrukturen erkannt werden, wird die todbringende Fracht ausgeliefert, d.h. das Gift wird in die Zelle eingeschleust. Fünf Zuckermoleküle (rote Sphären) sind in der abgebildeten Struktur an die fünf Regionen des Haptomers gebunden (nicht kovalent, nur als Ligand). Genau so docken die Zuckermoleküle der Zelloberfläche an das Haptomer an.
Wie wirkt
das Gift?
Nach dem Andocken
wird die aktive Kette befreit: Am oberen Ende der markanten
diagonalen Alpha-Helix (im obersten Bild gut zu sehen) wird eine
Disulfidbrücke gespalten, dann kann die schadensbringende
Aminosäurekette ihr Unwesen in der Zelle entfalten.
Einmal in die Zelle eingeschleust, kann es losgehen: Ein einziges Molekül Gift reicht aus, um die ganze Zelle lahmzulegen. Die beiden aktiven Polypeptidketten A1 und A2 stimulieren die Produktion des Enzyms Adenylatcyclase in den Epithelzellen des Darmes, was letztendlich zu massiven Durchfällen führt.
Die
Ähnlichkeit zum Choleratoxin
Vergleicht man
Enterotoxin und Choleratoxin,
fallen einem sehr viele Ähnlichkeiten ins Auge. Der Aufbau aus 5
gleichen Einheiten des Haptomers und die zwei unterschiedlichen
Ketten des Effektomers, die Fünfersymmetrie etc. Das hat auch
Vorteile, denn ein seit 2005 in Deutschland zur Verfügung
stehender Cholera-Impfstoff erzeugt auch Immunität
gegenüber enterotoxischen Escherichia coli.
Literatur:
Fritz H. Kayser, Kurt
A. Bienz, Johannes Eckert, Jean Lindenmann: Medizinische
Mikrobiologie, Thieme-Verlag, 8. Auflage 1993. S. 215-216
http://www.rcsb.org/pdb/molecules/pdb69_3.html
PDB-ID 1LTB, http://www.rcsb.org/pdb
PDB-ID 1 LTT, http://www.rcsb.org/pdb
Merritt, E. A., Pronk, S. E., Sixma, T.
K., Kalk, K. H., van Zanten, B. A., Hol, W. G.: Structure of
partially-activated E. coli heat-labile enterotoxin (LT) at 2.6 A
resolution. FEBS Lett 337 pp. 88 (1994)
Sixma, T. K., Pronk, S. E., Kalk, K. H., van Zanten, B. A.,
Berghuis, A. M., Hol, W. G.: Lactose binding to heat-labile
enterotoxin revealed by X-ray crystallography. Nature 355 pp. 561
(1992)
Chemie der Gifte
Andere pharmazeutische Seiten
![]() Home
Home
©
Text, Graphik und Photos: Bernhard Peter 2005
Impressum